Wat is Jakavi en waarvoor wordt dit middel gebruikt?
De werkzame stof in Jakavi is ruxolitinib.
Jakavi wordt gebruikt voor de behandeling van volwassen patiënten met een vergrote milt of met klachten die verband houden met myelofibrose, een zeldzame vorm van bloedkanker.
Jakavi wordt ook gebruikt voor de behandeling van volwassen patiënten met polycythemia vera die ongevoelig zijn voor hydroxycarbamide of die dit middel niet verdragen.
Jakavi wordt ook gebruikt voor de behandeling van patiënten van 12 jaar en ouder en volwassenen met graft-versus-host disease (GvHD, transplantaat-versus-gastheerziekte). Er zijn twee vormen van GvHD: de vroege vorm, acute GvHD, die doorgaans vrij snel na de transplantatie ontstaat en de huid, lever en het maag-darmkanaal kan aantasten, en chronische GvHD, die zich later ontwikkelt, meestal weken tot maanden na de transplantatie. Chronische GvHD kan vrijwel alle organen aantasten.
Myelofibrose (MF)
Jakavi is geïndiceerd voor de behandeling van aan de ziekte gerelateerde splenomegalie of symptomen bij volwassen patiënten met primaire myelofibrose (ook chronische idiopathische myelofibrose genoemd), post-polycythemia vera-myelofibrose of post-essentiële trombocytemie-myelofibrose.
Polycythemia vera (PV)
Jakavi is geïndiceerd voor de behandeling van volwassen patiënten met polycythemia vera die resistent zijn tegen hydroxycarbamide of die dit middel niet verdragen.
Graft-versus-host disease (GvHD)
Jakavi is geïndiceerd voor de behandeling van patiënten van 12 jaar en ouder met acute graft-versus-host disease of chronische graft-versus-host disease die een ontoereikende respons vertonen op corticosteroïden of andere systemische behandelingen (zie rubriek 5.1 van de SmPC).
Dosering
Behandeling met Jakavi dient alleen te worden gestart door een arts die ervaring heeft met het gebruik van geneesmiddelen tegen kanker.
Voordat een behandeling met Jakavi wordt gestart, moet een complete bloedceltelling worden uitgevoerd met inbegrip van een differentiële witte bloedceltelling.
De complete bloedtelling met inbegrip van een differentiële wittebloedceltelling dient elke 2-4 weken te worden gecontroleerd tot de dosering van Jakavi gestabiliseerd is en daarna indien klinisch geïndiceerd (zie rubriek 4.4 van de SmPC).
Dosering
Startdosering
De aanbevolen startdosering van Jakavi bij myelofibrose (MF) is gebaseerd op de bepaling van het aantal bloedplaatjes (zie Tabel 1):
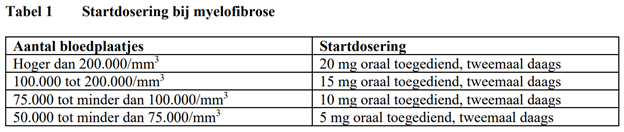
De aanbevolen startdosering van Jakavi bij polycythemia vera (PV) is tweemaal daags 10 mg oraal toegediend.
De aanbevolen startdosering van Jakavi bij acute en chronische graft-versus-host disease (GvHD) is tweemaal daags 10 mg oraal toegediend. Jakavi kan worden gebruikt in combinatie met corticosteroïden en/of calcineurineremmers (CNI’s), die dan ook gebruikt kunnen blijven worden.
Dosisaanpassingen
De dosering mag worden getitreerd op geleide van de werkzaamheid en de veiligheid.
Myelofibrose en polycythemia vera
Als de werkzaamheid onvoldoende geacht wordt en de bloedwaardenbepalingen nauwkeuring zijn, kan de dosis met maximaal 5 mg tweemaal daags verhoogd worden tot een maximale dosis van 25 mg tweemaal daags.
De startdosis mag niet worden verhoogd gedurende de eerste 4 weken van de behandeling en daarna niet vaker dan met een interval van 2 weken.
De behandeling moet worden gestaakt als het aantal bloedplaatjes lager is dan 50.000/mm3 of als het absolute aantal neutrofielen lager is dan 500/mm3 . Bij PV dient de behandeling ook te worden onderbroken wanneer de concentratie hemoglobine lager is dan 8 g/dl (5,0 mmol/l). Na herstel van de bloedwaarden boven deze waarden, mag de toediening worden hervat met tweemaal daags 5 mg en geleidelijk worden verhoogd gebaseerd op zorgvuldige controle van de complete bloedceltelling met inbegrip van de differentiële witte bloedceltelling.
Een verlaging van de dosering moet worden overwogen als het aantal bloedplaatjes gedurende de behandeling daalt zoals weergegeven in Tabel 2, om een onderbreking van de toediening wegens trombocytopenie te voorkomen.
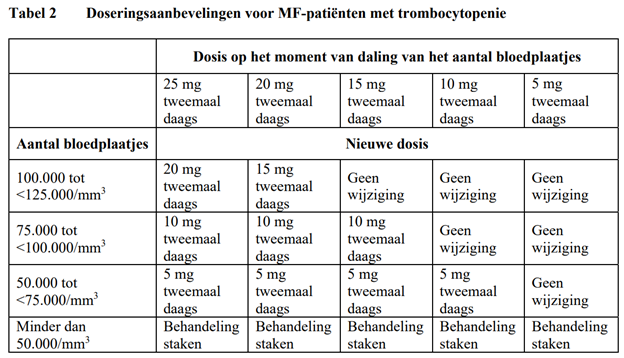
Bij PV dienen dosisverminderingen ook te worden overwogen als de concentratie hemoglobine onder 12 g/dl (7,5 mmol/l) daalt en worden dosisverminderingen aanbevolen als de concentratie hemoglobine onder 10 g/dl (6,2 mmol/l) daalt.
Graft-versus-host disease
Dosisreducties en tijdelijke behandelingsonderbrekingen kunnen vereist zijn voor GvHD-patiënten met trombocytopenie, neutropenie of verhoogd totaal bilirubine na standaard ondersteunende therapie inclusief groeifactoren, infectiebestrijdende behandelingen en transfusies. Er wordt een enkele stap voor reductie van het dosisniveau aanbevolen (van 10 mg tweemaal daags naar 5 mg tweemaal daags of van 5 mg tweemaal daags naar 5 mg eenmaal daags). Bij patiënten die een dosis Jakavi van 5 mg eenmaal daags niet kunnen verdragen, dient de behandeling te worden onderbroken. Gedetailleerde doseringsaanbevelingen staan vermeld in Tabel 3.
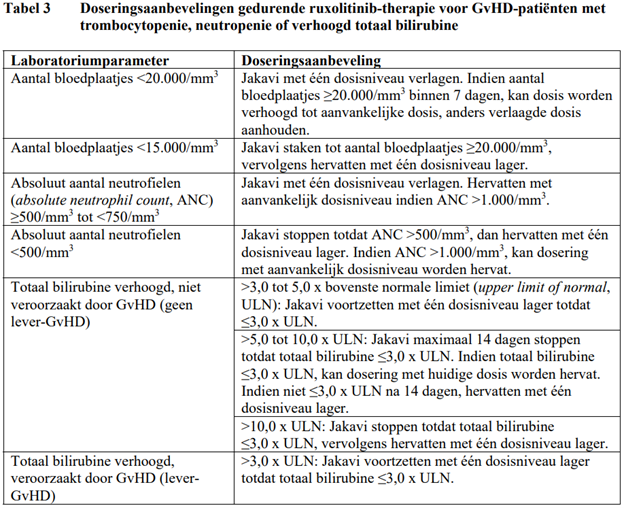
Dosisaanpassing bij gelijktijdig gebruik van sterke CYP3A4-remmers of duale CYP2C9/3A4-remmers
Wanneer ruxolitinib wordt toegediend met sterke CYP3A4-remmers of tweevoudige remmers van CYP2C9- en CYP3A4-enzymen (bv. fluconazol), moet de eenheidsdosis van ruxolitinib worden verlaagd met ongeveer 50%, tweemaal daags toe te dienen (zie rubriek 4.5). Het gelijktijdig gebruik van ruxolitinib en fluconazoldoses hoger dan 200 mg per dag moet worden vermeden.
Frequentere controle (bv. tweemaal per week) van de hematologische parameters en de klinische verschijnselen en klachten van aan ruxolitinib gerelateerde bijwerkingen wordt aanbevolen gedurende de behandeling met sterke CYP3A4-remmers of tweevoudige remmers van CYP2C9- en CYP3A4- enzymen.
Speciale patiëntgroepen
Nierfunctiestoornissen
Er is geen specifieke dosisaanpassing nodig bij patiënten met milde of matige nierfunctiestoornissen.
Bij patiënten met ernstige nierfunctiestoornissen (creatinineklaring lager dan 30 ml/min) moet de aanbevolen startdosering gebaseerd op het aantal bloedplaatjes bij MF-patiënten worden verlaagd met ongeveer 50%, tweemaal per dag toe te dienen. De aanbevolen startdosering bij PV- en GvHD-patiënten met een ernstige nierfunctiestoornis bedraagt 5 mg tweemaal daags. De patiënten moeten tijdens de behandeling met ruxolitinib zorgvuldig worden gevolgd wat betreft de veiligheid en de werkzaamheid.
Er zijn beperkte gegevens om de beste doseringsopties te bepalen voor patiënten met nierziekte in het eindstadium (ESRD) die hemodialyse ondergaan. Farmacokinetische/farmacodynamische simulaties op basis van beschikbare gegevens in deze patiëntgroep wijzen erop dat de startdosis bij MF-patiënten met ESRD die hemodialyse ondergaan een enkelvoudige dosis van 15-20 mg of twee doses van 10 mg, gegeven met een interval van 12 uur, is, die moet worden toegediend na de dialyse en enkel op de dag van de hemodialyse. Een enkelvoudige dosis van 15 mg is aanbevolen voor MF-patiënten met het aantal bloedplaatjes tussen de 100.000/mm³ en 200.000/mm³. Een enkelvoudige dosis van 20 mg of twee doses van 10 mg, gegeven met een interval van 12 uur, is aanbevolen voor MF-patiënten met het aantal bloedplaatjes >200.000/mm³. De volgende doses (enkelvoudige toediening of twee doses van 10 mg, gegeven met een interval van 12 uur) moeten enkel worden toegediend op de hemodialysedagen na elke dialysesessie.
De aanbevolen startdosering voor PV-patiënten met ESRD op hemodialyse is één enkele dosis van 10 mg of twee doses van 5 mg met een interval van 12 uur, toe te dienen na de dialyse en alleen op de dag van de hemodialyse. Deze dosisaanbevelingen zijn gebaseerd op simulaties en elke dosisaanpassing in ESRD zou moeten gebeuren onder zorgvuldige controle van de veiligheid en de werkzaamheid bij individuele patiënten. Er zijn geen gegevens beschikbaar over dosering bij patiënten die peritoneale dialyse of continue venoveneuze hemofiltratie ondergaan (zie rubriek 5.2 van de SmPC).
Er zijn geen gegevens beschikbaar voor GvHD-patiënten met ESRD.
Leverfunctiestoornissen
Bij MF-patiënten met leverfunctiestoornissen moet de aanbevolen startdosering gebaseerd op het aantal bloedplaatjes worden verlaagd met ongeveer 50%, tweemaal per dag toe te dienen. De volgende doses moeten worden aangepast onder zorgvuldige controle van de veiligheid en de werkzaamheid. De aanbevolen startdosering is 5 mg tweemaal daags voor PV-patiënten. Patiënten met een leverfunctiestoornis die ruxolitinib krijgen, dienen een complete bloedceltelling te krijgen met inbegrip van een differentiële witte bloedceltelling. Dit dient ten minste elke één tot twee weken tijdens de eerste 6 weken na de start van de behandeling met ruxolitinib te worden gecontroleerd en daarna indien klinisch geïndiceerd zodra hun leverfunctie en het aantal bloedcellen gestabiliseerd zijn. De dosering van ruxolitinib kan worden getitreerd om het risico op cytopenie te verlagen.
Bij patiënten met lichte, matige of ernstige leverfunctiestoornis die geen verband houdt met GvHD moet de startdosering van ruxolitinib met 50% worden verlaagd (zie rubriek 5.2 van de SmPC).
Bij patiënten met GvHD-symptomen van de lever en verhoging van totaal bilirubine tot >3 x ULN moeten de bloedwaarden vaker worden gemonitord op toxiciteit en is een dosisreductie met één niveau aanbevolen.
Oudere patiënten (≥65 jaar)
Er zijn geen aanvullende dosisaanpassingen aanbevolen voor oudere patiënten.
Pediatrische patiënten
De veiligheid en werkzaamheid van Jakavi bij kinderen en jongeren in de leeftijd tot 18 jaar met MF en PV zijn niet vastgesteld. Er zijn geen gegevens beschikbaar (zie rubriek 5.1 van de SmPC).
Bij pediatrische patiënten (12 jaar en ouder) met GvHD worden de veiligheid en werkzaamheid van Jakavi onderbouwd door bewijs uit de gerandomiseerde fase 3-studies REACH2 en REACH3. De Jakavi-dosis bij pediatrische patiënten met GvHD van 12 jaar en ouder is identiek aan die voor volwassenen. De veiligheid en werkzaamheid van Jakavi bij patiënten onder de 12 jaar zijn niet aangetoond.
Staken van de behandeling
De behandeling van MF en PV mag worden voortgezet zolang de baten-risicoverhouding gunstig blijft. De behandeling moet echter na 6 maanden worden gestaakt indien er geen vermindering van de miltgrootte is of geen verbetering van symptomen sinds de start van de behandeling.
Het is aanbevolen dat, voor patiënten die enige mate van klinische vooruitgang vertonen, de behandeling met ruxolitinib wordt gestaakt indien ze een toename van de miltlengte van 40% behouden in vergelijking met de uitgangswaarde (ruwweg overeenkomend met een 25% toename van het miltvolume) en niet langer een voelbare verbetering vertonen van ziektegerelateerde symptomen.
Bij GvHD kan geleidelijke verlaging van Jakavi worden overwogen voor patiënten met een respons nadat gebruik van corticosteroïden is gestaakt. Een dosisreductie van 50% van Jakavi om de twee maanden wordt aanbevolen. Indien de tekenen of symptomen van GvHD zich opnieuw voordoen na het afbouwen van de dosis Jakavi, moet herescalatie van de behandeling worden overwogen.
Wijze van toediening
Jakavi wordt oraal ingenomen, met of zonder voedsel.
Indien een dosis wordt vergeten, dient de patiënt geen aanvullende dosis in te nemen, maar moet hij de gebruikelijke volgende dosis innemen.
Vragen over onze geneesmiddelen
Veiligheid van de patiënt staat bij ons hoog in het vaandel. Daarom is onze Medische Informatie Dienst bereikbaar voor vragen van patiënten en professionals in de gezondheidszorg met betrekking tot alle aspecten van het gebruik of informatie over een geneesmiddel van Novartis.
Contactinformatie
E: [email protected]
T: 088-0452111
Bijwerking melden
Als we op de hoogte zijn van eventuele bijwerkingen, kunnen we die verder onderzoeken. We verzoeken je om bijwerkingen direct bij ons te melden. Novartis zal de informatie verwerken en eventueel contact met je opnemen. Je kunt een bijwerking bij ons melden via het onderstaande contactformulier.