Wat is Entresto en waarvoor wordt dit middel gebruikt?
Entresto is een geneesmiddel dat een angiotensinereceptor-neprilysineremmer bevat. Het levert twee werkzame stoffen op, sacubitril en valsartan.
Entresto wordt gebruikt voor het behandelen van een vorm van langdurig hartfalen bij volwassenen.
Deze vorm van hartfalen treedt op wanneer het hart zwak is en niet genoeg bloed kan rondpompen naar de longen en de rest van het lichaam. De meest voorkomende klachten bij hartfalen zijn kortademigheid, vermoeidheid, moeheid en zwelling van de enkels.
Therapeutische indicaties
Hartfalen bij volwassenen
Entresto is geïndiceerd bij volwassen patiënten voor de behandeling van symptomatisch chronisch hartfalen met verminderde ejectiefractie (zie rubriek 5.1 van de SmPC).
Hartfalen bij kinderen
Entresto is geïndiceerd bij kinderen en adolescenten van één jaar of ouder voor de behandeling van symptomatisch chronisch hartfalen met systolische functiestoornis van de linkerventrikel (zie rubriek 5.1 van de SmPC).
Dosering
Algemene overwegingen
Entresto moet niet tegelijk met een angiotensine-converting enzym (ACE)-remmer of een angiotensine-II-receptorblokker (ARB) worden gebruikt. Vanwege het mogelijke risico op angio-oedeem bij gelijktijdig gebruik met een ACE-remmer, mag het niet worden gestart gedurende ten minste 36 uur na het stopzetten van de behandeling met een ACE-remmer (zie rubriek 4.3, 4.4 en 4.5 van de SmPC).
Het valsartan aanwezig in Entresto heeft een hogere biologische beschikbaarheid dan het valsartan in andere tabletformuleringen die op de markt zijn (zie rubriek 5.2 van de SmPC).
Als een dosis wordt vergeten, moet de patiënt de volgende dosis innemen op het geplande tijdstip.
Hartfalen bij volwassenen
De aanbevolen startdosis van Entresto is één tablet van 49 mg/51 mg tweemaal daags, behalve in de situaties zoals hieronder beschreven. De dosis dient na 2 tot 4 weken verdubbeld te worden tot de doeldosering van 97 mg/103 mg tweemaal daags, indien verdragen door de patiënt (zie rubriek 5.1 van de SmPC).
Als patiënten verdraagbaarheidsproblemen (systolische bloeddruk [SBD] ≤ 95 mmHg, symptomatische hypotensie, hyperkaliëmie, nierdisfunctie) krijgen, wordt aanpassing van gelijktijdig gebruikte geneesmiddelen, tijdelijke dosisverlaging of stopzetting van Entresto aanbevolen (zie rubriek 4.4 van de SmPC).
In de PARADIGM-HF-studie werd Entresto toegediend in combinatie met andere therapieën voor hartfalen, in plaats van een ACE-remmer of andere ARB (zie rubriek 5.1 van de SmPC). Er is beperkte ervaring bij patiënten die momenteel geen ACE-remmer of een ARB gebruiken, of lage doses van ACE-remmers of ARB’s gebruiken. Daarom wordt een startdosis van 24 mg/26 mg tweemaal daags en langzame dosistitratie (verdubbeling iedere 3-4 weken) aanbevolen bij deze patiënten (zie “TITRATION” in rubriek 5.1 van de SmPC).
De behandeling dient niet te worden gestart bij patiënten met een serumkaliumniveau > 5,4 mmol/l of met een SBD < 100 mmHg (zie rubriek 4.4 van de SmPC). Een startdosis van 24 mg/26 mg tweemaal daags moet overwogen worden voor patiënten met een SBD ≥ 100 tot 110 mmHg.
Hartfalen bij kinderen
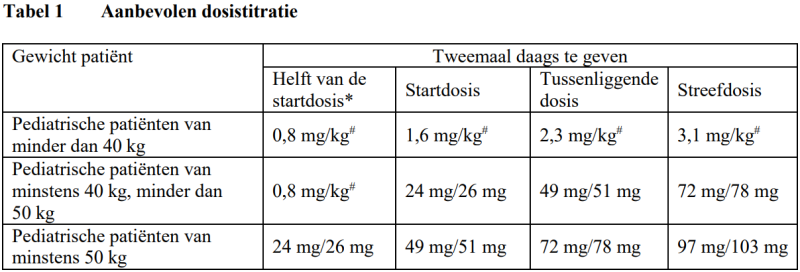
Tabel 1 toont de aanbevolen dosis voor pediatrische patiënten. De aanbevolen dosis moet tweemaal daags oraal worden ingenomen. De dosis moet om de 2-4 weken worden verhoogd tot de streefdosis, zoals die door de patiënt wordt verdragen.
Entresto filmomhulde tabletten zijn niet geschikt voor kinderen die minder dan 40 kg wegen. Voor deze patiënten is Entresto granulaat beschikbaar.
* De helft van de startdosis wordt aanbevolen bij patiënten die geen ACE-remmer of een ARB hebben gebruikt of lage doses van deze geneesmiddelen hebben gebruikt, patiënten met een verminderde nierfunctie (geschatte glomerulaire filtratiesnelheid (Estimated Glomerular Filtration Rate) [eGFR] < 60 ml/min/1,73 m2) en patiënten met een matig verminderde leverfunctie (zie speciale patiëntengroepen). #0,8 mg/kg, 1,6 mg/kg, 2,3 mg/kg en 3,1 mg/kg verwijzen naar de gecombineerde hoeveelheid van sacubitril en valsartan en moeten worden toegediend met behulp van granulaat.
Bij patiënten die momenteel geen ACE-remmer of ARB gebruiken of die lage doses van deze geneesmiddelen gebruiken, wordt de helft van de startdosis aanbevolen. Voor pediatrische patiënten met een gewicht van 40 kg tot minder dan 50 kg wordt een startdosis van 0,8 mg/kg tweemaal daags (gegeven als granulaat) aanbevolen. Na de start moet de dosis worden verhoogd tot de standaard startdosis volgens de aanbevolen dosistitratie in tabel 1 en om de 3-4 weken worden aangepast.
Bijvoorbeeld, een pediatrische patiënt van 25 kg die niet eerder een ACE-remmer heeft gebruikt, moet beginnen met de helft van de standaard startdosis, wat overeenkomt met 20 mg (25 kg × 0,8 mg/kg) tweemaal daags, gegeven als granulaat. Na afronding naar het dichtstbijzijnde aantal volledige capsules komt dit overeen met tweemaal daags 2 capsules van 6 mg/6 mg sacubitril/valsartan.
De behandeling mag niet worden gestart bij patiënten met een serumkaliumgehalte > 5,3 mmol/l of met een SBD < 5e percentiel voor de leeftijd van de patiënt. Indien patiënten verdraagbaarheidsproblemen ondervinden (SBD < 5e percentiel voor de leeftijd van de patiënt, symptomatische hypotensie, hyperkaliëmie, verminderde nierfunctie), wordt aanpassing van bijkomende geneesmiddelen, tijdelijke neertitratie of stopzetting van Entresto aanbevolen (zie rubriek 4.4 van de SmPC).
Speciale patiëntengroepen
Ouderen
De dosis moet in overeenstemming zijn met de nierfunctie van de oudere patiënt.
Verminderde nierfunctie
Er is geen dosisaanpassing nodig bij patiënten met een licht (eGFR 60-90 ml/min/1,73 m2) verminderde nierfunctie.
De helft van de startdosis moet overwogen worden voor patiënten met een matig verminderde nierfunctie (eGFR 30-60 ml/min/1,73 m2) Aangezien er zeer beperkte klinische ervaring is bij patiënten met een ernstig verminderde nierfunctie (eGFR < 30 ml/min/1,73 m2) (zie rubriek 5.1 van de SmPC) moet Entresto met voorzichtigheid worden gebruikt en wordt de helft van de startdosis aanbevolen. Bij pediatrische patiënten met een gewicht van 40 kg tot minder dan 50 kg wordt een startdosis van 0,8 mg/kg tweemaal daags (gegeven als granulaat) aanbevolen. Na de start moet de dosis worden verhoogd volgens de aanbevolen dosistitratie om de 2-4 weken.
Er is geen ervaring bij patiënten met eindstadium nierfalen en gebruik van Entresto wordt niet aanbevolen.
Verminderde leverfunctie
Er is geen dosisaanpassing vereist bij het toedienen van Entresto aan patiënten met een licht verminderde leverfunctie (Child-Pugh-klasse A).
Er is beperkte klinische ervaring bij patiënten met een matig verminderde leverfunctie (Child-Pugh-klasse B) of met aspartaataminotransferase (ASAT)/alanineaminotransferase (ALAT)- waardes meer dan tweemaal de bovenlimiet van het normale bereik. Entresto moet met voorzichtigheid worden gebruikt bij deze patiënten en de helft van de startdosis is aanbevolen (zie rubriek 4.4 en 5.2 van de SmPC). Bij pediatrische patiënten met een gewicht van 40 kg tot minder dan 50 kg wordt een startdosis van 0,8 mg/kg tweemaal daags (gegeven als granulaat) aanbevolen. Na de start moet de dosis worden verhoogd volgens de aanbevolen dosistitratie om de 2-4 weken.
Entresto is gecontra-indiceerd bij patiënten met een ernstig verminderde leverfunctie, biliaire cirrose of cholestase (Child-Pugh-klasse C) (zie rubriek 4.3 van de SmPC).
Pediatrische patiënten
De veiligheid en werkzaamheid van Entresto bij kinderen jonger dan 1 jaar is niet vastgesteld. De momenteel beschikbare gegevens worden beschreven in rubriek 5.1 van de SmPC, maar er kan geen doseringsadvies worden gegeven.
Wijze van toediening
Oraal gebruik.
Entresto kan met of zonder voedsel worden toegediend (zie rubriek 5.2 van de SmPC). De tabletten moeten met een glas water worden ingenomen. Het wordt niet aanbevolen de tabletten te breken of fijn te maken.
Vragen over onze geneesmiddelen
Veiligheid van de patiënt staat bij ons hoog in het vaandel. Daarom is onze Medische Informatie Dienst bereikbaar voor vragen van patiënten en professionals in de gezondheidszorg met betrekking tot alle aspecten van het gebruik of informatie over een geneesmiddel van Novartis.
Contactinformatie
E: [email protected]
T: 088-0452111
Bijwerking melden
Als we op de hoogte zijn van eventuele bijwerkingen, kunnen we die verder onderzoeken. We verzoeken je om bijwerkingen direct bij ons te melden. Novartis zal de informatie verwerken en eventueel contact met je opnemen. Je kunt een bijwerking bij ons melden via het onderstaande contactformulier.