Wat is Kisqali?
Kisqali bevat de werkzame stof ribociclib en behoort tot een groep geneesmiddelen die cyclineafhankelijke-kinaseremmers (CDK-remmers) worden genoemd.
Waarvoor wordt dit middel gebruikt?
Dit middel wordt gebruikt bij vrouwen met lokaal gevorderde of naar andere delen van het lichaam uitgezaaide (gemetastaseerde) borstkanker van een type dat wordt aangeduid met hormoonreceptorpositieve, humane epidermale-groeifactorreceptor (HER2)-negatieve borstkanker. Het wordt gebruikt in combinatie met een aromataseremmer of fulvestrant, welke gebruikt worden als hormonale kankertherapieën.
Therapeutische indicaties
Kisqali is geïndiceerd voor de behandeling van vrouwen met lokaal gevorderde of gemetastaseerde hormoonreceptorpositieve (HR-positieve), humane epidermale-groeifactorreceptor 2-negatieve (HER2-negatieve) borstkanker in combinatie met een aromataseremmer of fulvestrant als initiële
endocriengebaseerde therapie, of bij vrouwen die eerdere endocriene therapie hebben ontvangen. Bij pre- of perimenopauzale vrouwen moet de endocriene therapie worden gecombineerd met een luteïniserend-hormoon-‘releasing’-hormoon(LHRH)-agonist.
Dosering
Behandeling met Kisqali dient te worden ingesteld door een arts die ervaring heeft met het gebruik van behandelingen tegen kanker.
Dosering
De aanbevolen dosis is 600 mg (drie filmomhulde tabletten met elk 200 mg) ribociclib eenmaal daags gedurende 21 achtereenvolgende dagen, gevolgd door 7 dagen geen behandeling, zodat een volledige cyclus uit 28 dagen bestaat. De behandeling dient te worden voortgezet zo lang als de patiënt klinisch baat heeft bij de behandeling of totdat onaanvaardbare toxiciteit optreedt.
Kisqali dient in combinatie met 2,5 mg letrozol of een andere aromataseremmer of met 500 mg fulvestrant te worden gebruikt.
Wanneer Kisqali gebruikt wordt in combinatie met een aromataseremmer, dient de aromataseremmer ononderbroken gedurende de hele cyclus van 28 dagen eenmaal daags oraal te worden ingenomen. Raadpleeg de samenvatting van de productkenmerken (SmPC) van de aromataseremmer voor aanvullende informatie.
Wanneer Kisqali gebruikt wordt in combinatie met fulvestrant, wordt fulvestrant intramusculair toegediend op dag 1, 15 en 29, en daarna een keer per maand. Raadpleeg de samenvatting van de productkenmerken (SmPC) van fulvestrant voor aanvullende informatie.
Behandeling van pre- en perimenopauzale vrouwen met de goedgekeurde Kisqali-combinaties dient tevens een LHRH-agonist te bevatten in lijn met de lokale klinische praktijk.
Kisqali kan ingenomen worden met of zonder voedsel (zie rubriek 4.5 van de SmPC). Patiënten moeten aangemoedigd worden hun dosis elke dag op ongeveer hetzelfde tijdstip in te nemen, bij voorkeur 's morgens. Als de patiënt na het innemen van de dosis braakt of een dosis vergeet, dient op die dag niet alsnog een dosis te worden ingenomen. De volgende voorgeschreven dosis dient op het gebruikelijk tijdstip te worden ingenomen.
Dosisaanpassingen
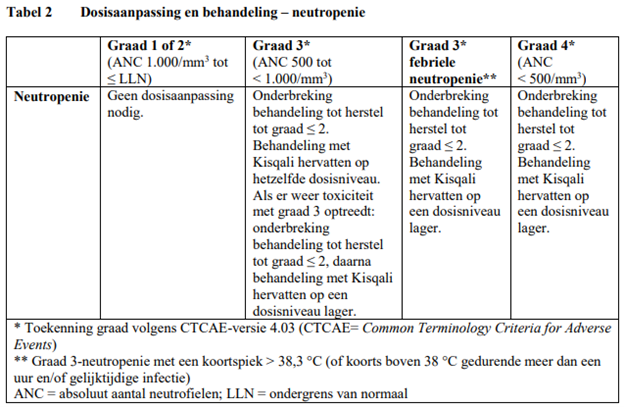
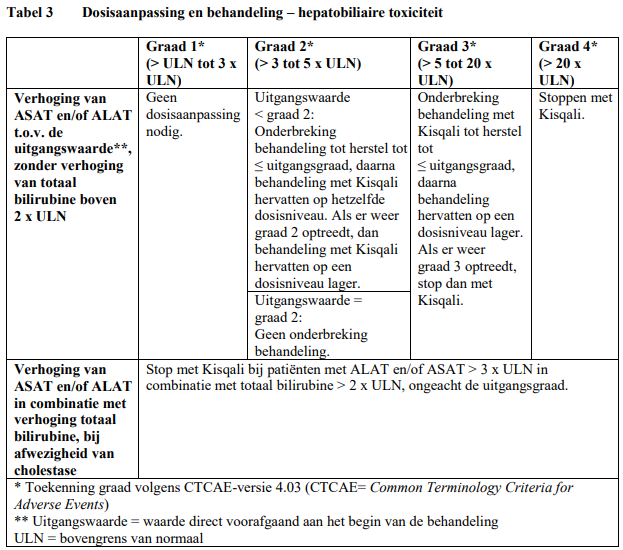
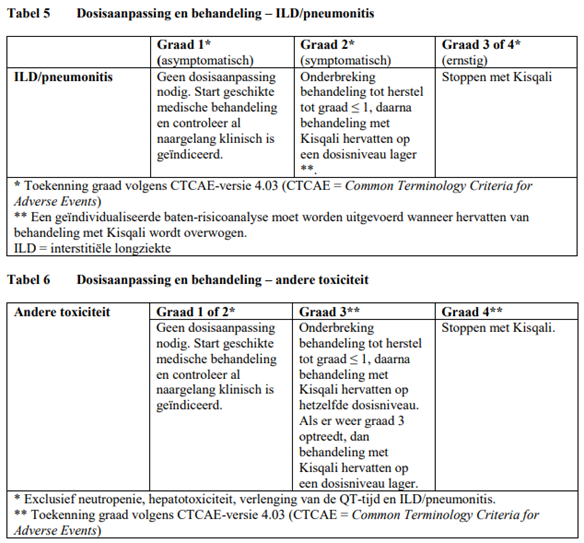
Voor behandeling van ernstige of onverdraagbare bijwerkingen (adverse reactions, AR's) kan het nodig zijn de dosis van Kisqali tijdelijk te verlagen of de behandeling met Kisqali te onderbreken of te staken. Als verlaging van de dosis nodig is, kunnen de richtlijnen voor een aanbevolen verlaging van de dosis in tabel 1 worden geraadpleegd.

Tabel 2, 3, 4, 5 en 6 vormen een overzicht van aanbevelingen voor verlaging van de dosis van Kisqali of onderbreking of beëindiging van de behandeling met Kisqali bij de behandeling van specifieke AR's. Het klinisch oordeel van de behandelende arts dient richting te geven aan het behandelingsplan voor elke patiënt op basis van een beoordeling van de voordelen en risico's voor die bepaalde patiënt (zie rubriek 4.4 van de SmPC).
Er dient een volledig bloedbeeld (CBC) te worden bepaald voordat er met de behandeling met Kisqali wordt begonnen. Nadat er met de behandeling is begonnen, dient er gedurende de eerste 2 cycli om de 2 weken een CBC te worden bepaald, bij het begin van elk van de volgende 4 cycli, daarna al naargelang klinisch is geïndiceerd.
Er dienen leverfunctietesten (LFT's) te worden gedaan voordat er met de behandeling met Kisqali wordt begonnen. Nadat er met de behandeling is begonnen, dienen er gedurende de eerste 2 cycli om de 2 weken LFT's te worden gedaan, bij het begin van elke van de volgende 4 cycli, daarna al naargelang klinisch is geïndiceerd. Als er afwijkingen met graad ≥ 2 worden gezien, wordt aanbevolen vaker te controleren.
Het ECG dient te worden beoordeeld voordat er met de behandeling met Kisqali wordt begonnen. Nadat er met de behandeling is begonnen, dient het ECG te worden herhaald op ongeveer dag 14 van de eerste cyclus en bij het begin van de tweede cyclus, daarna al naargelang klinisch is geïndiceerd. In het geval van verlenging van de QTcF-tijd tijdens de behandeling, wordt aanbevolen vaker een ECG af te nemen.

Er wordt verwezen naar de SmPC van de gelijktijdig toegediende aromataseremmer, fulvestrant of LHRH-agonist voor een aanbevolen aanpassing van de dosis en andere relevante veiligheidsinformatie in geval van toxiciteit.
Dosisaanpassing voor gebruik van Kisqali met sterke CYP3A4-remmers
Gelijktijdig gebruik van sterke CYP3A4-remmers dient te worden vermeden en er dienen andere geneesmiddelen die CYP3A4 minder sterk remmen te worden overwogen voor gelijktijdige toediening. Als het toch nodig is om een patiënt gelijktijdig ribociclib en een sterke CYP3A4-remmer te geven, dient de dosis van Kisqali te worden verminderd tot 400 mg eenmaal daags (zie rubriek 4.5 van de SmPC).
Bij patiënten bij wie de dosis verminderd werd tot dagelijks 400 mg ribociclib en bij wie het opstarten van de gelijktijdige toediening van een sterke CYP3A4-remmer niet kan worden vermeden, moet de dosis verder verminderd worden tot 200 mg.
Bij patiënten bij wie de dosis verminderd werd tot dagelijks 200 mg ribociclib en bij wie het opstarten van de gelijktijdige toediening van een sterke CYP3A4-remmer niet kan worden vermeden, moet de behandeling met Kisqali onderbroken worden.
Door verschillen tussen patiënten zullen de aanbevolen dosisaanpassingen mogelijk niet optimaal zijn bij alle patiënten; zorgvuldige controle op verschijnselen van toxiciteit wordt daarom aanbevolen. Als er wordt gestopt met de sterke CYP3A4-remmer, dient er na minstens 5 halfwaardetijden van deze remmer verder te worden gegaan met de dosis van Kisqali die werd gebruikt voorafgaand aan de start van de behandeling met die sterke CYP3A4-remmer (zie rubriek 4.4, 4.5 en 5.2 van de SmPC).
Bijzondere patiëntengroepen
Nierinsufficiëntie
Bij patiënten met lichte tot matige nierinsufficiëntie hoeft de dosering niet te worden aangepast. Een startdosis van 200 mg wordt aanbevolen bij patiënten met ernstige nierinsufficiëntie. Kisqali is niet onderzocht bij patiënten met borstkanker met ernstige nierinsufficiëntie (zie rubrieken 4.4, 5.1 en 5.2 van de SmPC).
Leverinsufficiëntie
Er is geen dosisaanpassing nodig bij patiënten met lichte leverinsufficiëntie (Child-Pughscore A). Bij patiënten met matige (Child-Pughscore B) en ernstige leverinsufficiëntie (Child-Pughscore C) kan er sprake zijn van een verhoogde (minder dan 2-voudige) blootstelling aan ribociclib en er wordt een aanvangsdosis van 400 mg Kisqali eenmaal daags aanbevolen (zie rubriek 5.2 van de SmPC).
Pediatrische patiënten
De veiligheid en werkzaamheid van Kisqali bij kinderen en adolescenten tot 18 jaar zijn niet vastgesteld. Er zijn geen gegevens beschikbaar.
Ouderen
Er is bij patiënten boven de 65 jaar geen dosisaanpassing nodig (zie rubriek 5.2 van de SmPC).
Wijze van toediening
Kisqali dient eenmaal daags oraal te worden ingenomen, met of zonder voedsel. De tabletten moeten heel worden doorgeslikt en mogen niet worden stukgekauwd, verpulverd of gebroken voordat ze worden doorgeslikt. Neem geen tablet in die gebroken is, gebarsten of anderszins niet intact is.
Vragen over onze geneesmiddelen
Veiligheid van de patiënt staat bij ons hoog in het vaandel. Daarom is onze Medische Informatie Dienst bereikbaar voor vragen van patiënten en professionals in de gezondheidszorg met betrekking tot alle aspecten van het gebruik of informatie over een geneesmiddel van Novartis.
Contactinformatie
E: [email protected]
T: 088-0452111
Bijwerking melden
Als we op de hoogte zijn van eventuele bijwerkingen, kunnen we die verder onderzoeken. We verzoeken je om bijwerkingen direct bij ons te melden. Novartis zal de informatie verwerken en eventueel contact met je opnemen. Je kunt een bijwerking bij ons melden via het onderstaande contactformulier.